
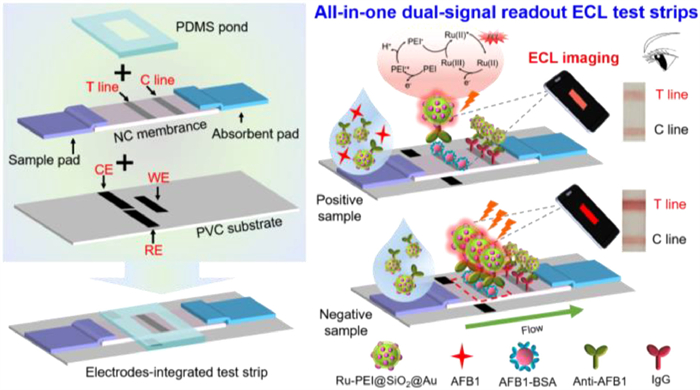
Smartphone-assisted electrochemiluminescence imaging test strips towards dual-signal visualized and sensitive monitoring of aflatoxin B1 in corn samples
English
Smartphone-assisted electrochemiluminescence imaging test strips towards dual-signal visualized and sensitive monitoring of aflatoxin B1 in corn samples
-
Key words:
- Electrochemiluminescence imaging
- / Test strips
- / Nanomaterials
- / Dual-signal outputs
- / Aflatoxin B1
- / Food safety
-
氰离子(CN-)作为一种剧毒性的阴离子,不可避免的应用于制药、塑料制造、电镀、金、银的萃取等工业领域[1, 2]。当然,CN-也可产生于食物消化以及吸烟等过程[3]。然而,存在于特定细胞中的CN-却能体现出重要的生理功能[4, 5]。一旦进入生物细胞,CN-将与细胞色素c氧化酶中的Fe3+快速结合,由此抑制正常的电子传输,进而引起细胞缺氧致死[6]。体内存在的CN-能够影响血管、视觉、内分泌和代谢系统的正常机体功能[7],对人体的致死量约为0.5~3.5 mg/kg[8]。世界卫生组织(WHO)明确规定饮用水中CN-的限量为1.9μmol/L[9]。我国生活饮用水卫生标准规定的CN-限量为0.05mg/L[10]。正因如此,CN-的可视化检测受到众多环境学家、生物学家以及化学家的高度重视[11, 12]。
传统的CN-检测方法主要有常规滴定法[13]和电化学滴定法[14],前者需要使用生物不相容的显色试剂,而后者要借助电化学工作站,两种方法均不适用于CN-的原位检测。与传统检测方法相比,基于单分子的比色传感器具有高灵敏度、成本低廉、适合原位“裸眼”检测等特点[15, 16]。另外,单分子传感器能够同时解决传感过程中的三大挑战(选择性、灵敏度以及标准化)[17],因而受到众多科技工作者的关注。通常,此类传感器存在水溶性和生物兼容性差、易形成二次污染等缺点。例如,Li等[18]通过二噻吩乙烯类试剂在乙腈溶液中实现了CN-的比色检测;魏太保等[19]的研究显示,在DMSO溶液中,咪唑并吩嗪内酰胺荧光传感器对CN-表现出较好的选择性识别能力。但是,纯水相中CN-检测仍然是一项具有挑战性的工作。
为了拓展应用性,常采用亲水基团功能化的策略增强传感器分子的水溶性[20]。例如,Li等[21]设计合成了羧基功能化的苯并吡咯盐衍生物,并在纯水相中实现了微量CN-的比色、荧光检测。磺酸功能化的分子具有较好的水溶性以及生物相容性[22, 23],因而适用于传感器的设计合成。另外,偶氮基团是一类常见的显色基团,已被广泛应用于单分子传感器的设计中[24~26]。前期研究工作表明[27, 28],偶氮酚羟基可通过脱质子的作用机理实现对碱性阴离子的比色检测。基于我们对分子、离子可视化检测方面的工作兴趣[29, 30],在此设计合成了水溶性的对磺酸功能化的偶氮水杨醛吖嗪(S)。由于偶氮酚羟基较强的酸性,在纯水相中经由质子转移,表现出对CN-高选择性的比色检测,而且这种质子转移具有较好的可逆性,从而使得S可重复利用;并且,利用S可实现自来水样中CN-的检测。
1. 实验部分
1.1 仪器及试剂
1H NMR图谱使用Bruker 400MHz(TMS为内标,DMSO-d6为氘代试剂)核磁共振谱仪于室温下测定;高分辨质谱采用Waters Xevo G2-S QTOF测定。采用X-4数字显示显微熔点仪进行熔点测定;紫外-可见光谱数据采集于Shimadzu UV-2550型紫外可见分光光度计(1cm石英池)。在上海雷磁PHS-25型pH计检测下配制4-羟乙基哌嗪乙硫磺酸(HEPES)缓冲溶液(10mmol/L)。
四丁基氰化铵购于百灵威科技有限公司;对氨基苯磺酸、水杨醛、水合肼(85%)、HEPES均购于阿拉丁试剂公司;合成中所用到的有机溶剂均购于天津大茂化学试剂有限公司。钠盐或钾盐均购于上海麦克林生化科技有限公司。自来水取自于贵州师范大学花溪校区,其他实验用水均为蒸馏水。无特殊说明,其他化学试剂均为市售分析纯级,未经进一步纯化而直接使用。
CN-储备液(10mmol/L)为四丁基铵盐的水溶液,其他阴离子储备液(10mmol/L)为适量钠盐或钾盐的水溶液。S(0.5mmol/L)的储备液分别由蒸馏水或自来水配制。
1.2 传感器分子的合成与表征
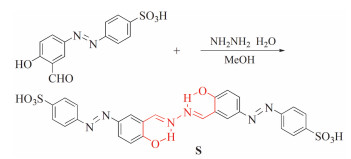
目标产物合成路线如图式 1所示。
图式 1
中间体对磺酸苯基偶氮水杨醛参考文献[22]合成。S参考前期工作[27]合成。具体合成过程为:将3.22g(10.5mmol)对磺酸苯基偶氮水杨醛溶于适量甲醇,室温下加入含5mmol水合肼(85%)的甲醇溶液,在催化量浓盐酸存在下搅拌反应3min后有黄色沉淀析出,3h后停止反应。过滤沉淀,粗产物用无水EtOH/DMF重结晶,得到2.83g黄色固体S,产率为93%,熔点> 250℃。1H NMR(400MHz,DMSO-d6) δ:9.17(s,2H,-SO3H),8.40~8.39 (d,J=2.50Hz,2H,CH),8.03~8.00 (dd,J=8.80、2.5 Hz,2H,ArH),7.85~7.77 (m,10H,ArH),7.18 (d,J=8.90Hz,2H,ArH);HRMS-ESI (m/z):C26H20N6O8S2 [M+Na]+,[M+2Na-H]+的计算值分别为631.0676、653.0495;实测值分别为631.0686、653.0496。
2. 结果与讨论
2.1 传感器S对CN-的选择性
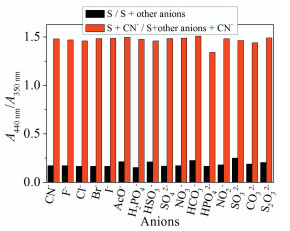
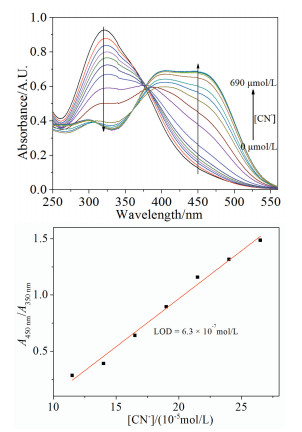
首先考察了各种阴离子(F-、Cl-、Br-、I-、AcO-、H2PO4-、HSO3-、SO42-、NO3-、CN-、HCO3-、HPO42-、NO2-、SO32-、CO32-和S2O32-)对S(20μmol/L)水溶液的紫外-可见光谱(UV-Vis)的响应性。由图 1(a)可知,不存在阴离子时,由于n-π*电子跃迁,S在纯水溶液(pH=6.80)中的最大吸收峰出现在350nm,溶液颜色为淡黄色。当加入20倍的阴离子(400μmol/L)后,只有CN-使其最大吸收波长红移至440nm,并呈现出宽带吸收。其他阴离子不能引起S溶液光谱响应,说明S对CN-表现出专一选择性。
图 1
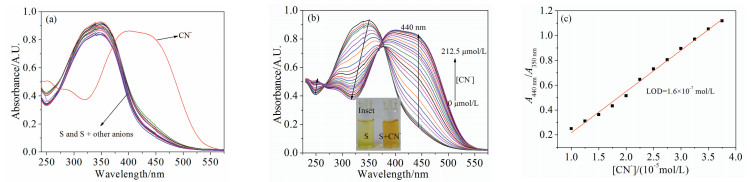 图 1. S(20μmol/L)在纯水中(a)对不同阴离子(20equiv)的UV-Vis光谱响应;(b) CN-对S(20μmol/L)的UV-Vis滴定曲线(插图:滴定前后溶液颜色的变化);(c)吸光度比率(A440nm/A350nm)与CN-浓度的线性关系、LOD的计算Figure 1. In pure water solution of S (20μmol/L), (a) UV-Vis absorbance responses to 20 equiv, anions; (b) UV-Vis absorption titration of S (Inset: the colour changes of S and S + CN-, respectively); (c) Linear plot of A440nm/A350nm for calculating detection limit of CN-
图 1. S(20μmol/L)在纯水中(a)对不同阴离子(20equiv)的UV-Vis光谱响应;(b) CN-对S(20μmol/L)的UV-Vis滴定曲线(插图:滴定前后溶液颜色的变化);(c)吸光度比率(A440nm/A350nm)与CN-浓度的线性关系、LOD的计算Figure 1. In pure water solution of S (20μmol/L), (a) UV-Vis absorbance responses to 20 equiv, anions; (b) UV-Vis absorption titration of S (Inset: the colour changes of S and S + CN-, respectively); (c) Linear plot of A440nm/A350nm for calculating detection limit of CN-2.2 传感器S对CN-的检测灵敏度
为了测定S对CN-的检测灵敏度,在纯水溶液中进行了UV-Vis光谱滴定实验,图 1(b)。随着CN-浓度的增加(0~212.5μmol/L),350nm处的吸收强度逐渐降低,而440nm处的新吸收峰强度逐渐增强,滴定至平衡时溶液颜色为橙色(插图),同时在266和376 nm处存在清晰的等吸收点,说明在此过程中有新物种出现。上述现象可能是S的偶氮酚羟基脱质子后形成对应的酚氧负离子所致[23~31]。光谱数据表明,S可实现水溶液中CN-的比率检测,吸收强度比率(A440nm/A350nm)与CN-浓度线性相关(图 1(c)),线性方程为:y=-0.11499+33224x。利用3SD/S法[28]得出检出限(LOD)为0.16μmol/L。值得说明的是,LOD低于WHO以及国内饮用水所规定的CN-最高限值。
2.3 CN-检测的干扰性测试
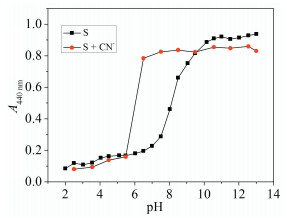
优良的检测试剂应该具有良好的抗干扰性。因而,考察S检测CN-的抗干扰能力尤为重要。由图 2可知,无论其他阴离子存在与否,A440nm/A350nm的比率强度基本相同,也就是说,S对CN-的比色检测基本不受其他阴离子的干扰。另外,考虑到S偶氮酚羟基的酸性以及CN-的碱性(pKa=9.3)[11],考察了HEPES缓冲溶液pH对S吸收光谱的影响(图 3),结果表明,在pH 2~7.5范围内,S在440nm处吸光度几乎没有变化,而pH高于7.5时,吸光度逐渐增大。当加入CN-后,吸光度在pH 5.5~8之间明显增强,说明S在6~9的pH范围内具有潜在应用。
图 2
图 3
2.4 S对CN-检测机制研究
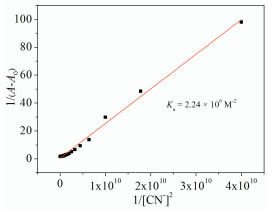
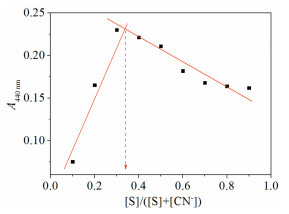
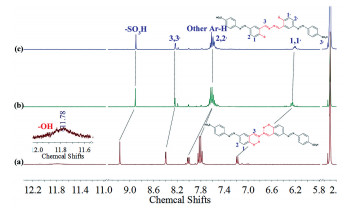
由Benesi-Hildebrand(B-H)曲线[32](图 4)可知,1/(A-A0)(A、A0分别代表加入和未加入CN-时S溶液在440nm处的吸光度)与CN-浓度平方的倒数(1/[CN-]2)成线性关系,通过截距/斜率计算得出S与CN-的结合常数为2.24×106 (mol/L)-2。为了明确S与CN-作用的化学计量比,保持总浓度([S]+[CN-]=20μmol/L)恒定下配制系列摩尔分数(0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9)的溶液并检测其吸收光谱,绘制Job’s曲线(图 5)。440nm处吸光度最大值对应S摩尔分数为0.33,说明S与CN-化学计量比为1:2。利用1H NMR滴定实验(图 6)研究了S(3mmol/L)对CN-的检测机制。由于磺酸基团的吸电子作用以及分子内氢键作用,偶氮酚羟基的化学位移出现在较低场(δ 11.78)(图 6(a)),当加入2倍量CN-后,由于偶氮酚羟基的脱质子化使其共振吸收完全消失,酚氧负离子S2-的形成使分子电荷密度增大,同时导致芳香氢的化学位移均向高场移动(Δδ1, 1′=0.97,Δδ2, 2′=0.45,Δδ3, 3′=0.17,Δδ-SO3H=0.27,Δδother Ar-H=0.21),其中偶氮酚羟基邻位芳香氢(H1, 1′)化学位移的变化最为明显(图 6(b))。而在5倍量CN-存在下,磺酸基团(δ 8.40)氢质子的共振吸收并没有消失(图 6(c)),说明在此过程中磺酸基团不参与质子转移。有趣的是,光谱实验证明这种质子转移(HCl提供H+)过程具有很好的可逆性(图 7),赋予S可重复利用的优势。
图 4
图 5
图 6
图 7
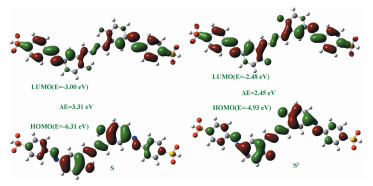
S对CN-检测机制进一步通过密度泛函理论(DFT)方法计算确证。运用Gaussian 03量子化学程序包,在B3LYP/6-311G(d, p)水平和PCM溶剂化模型下进行计算[33]。S结构优化结果(图 8)显示,偶氮酚羟基与吖嗪结构单元中的N原子通过六元环形成[Nδ-…Hδ+…Oδ-]分子内氢键,偶氮酚羟基的O-H…N键中,O-H和H…N的键长分别为0.9926和1.7486 Å,基于NAO的键级分别为0.6408和0.0880。S及其对应酚氧阴离子(S2-)结构优化及其理论计算结果表明,S对应最高占据轨道(HOMO)和最低空轨道(LUMO)能量分别为6.31和3.00 eV,能量带隙为3.31eV。当脱质子形成酚氧负离子S2-时,HOMO和LUMO能级分别为4.93和2.48 eV,对应带隙为2.45eV。该计算结果与光谱实验中UV-Vis吸收峰红移的结果一致。
图 8
光谱实验、1H NMR滴定实验以及DFT计算表明,传感器分子S经由偶氮酚羟基与CN-之间可逆的质子转移,进而增强了分子内电荷转移,由此实现了CN-的可视化检测。
2.5 应用研究
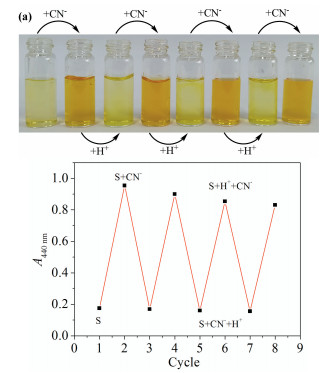
由于S在纯水相中对CN-表现出专一选择性的比色检测能力,据此制作了比色检测试纸(图 9(a))。将普通定性滤纸用S(20μmol/L)水溶液浸润30min后,烘干得到乳黄色检测试纸。将CN-水溶液(10mmol/L,15μL)滴到检测试纸表面,瞬间可观察到接触部分变为橙色,而其他常见干扰阴离子[34]存在时无明显的颜色变化。待CN-检测试纸自然晾干,继而滴加稀盐酸(10mmol/L,6μL)至橙色斑点,30s内橙色斑点消失,结果再次证实了可逆的质子转移机制。有趣的是,将上述实验中所用蒸馏水用自来水代替,同样可发现类似的显色效果,图 9(b)。由此可知,S在蒸馏水以及自来水中对CN-具有响应时间短(30s)、选择性及可视化程度高的优势,满足原位“裸眼”检测的需求。
图 9
另外,考察了S对自来水样中CN-的模拟检测。取贵州师范大学花溪校区自来水样,经0.22μm水性膜过滤后调节pH为6.80。进而利用该水样分别配制CN-(10mmol/L)和S(20μmol/L)溶液,并进行光谱滴定实验。如图 10所示,在CN-的浓度为28~149 μmol/L时,440nm处吸光度与CN-浓度呈良好的线性关系,说明在此浓度范围内,S可检测实际水样中的CN-[35],LOD为0.63μmol/L。
图 10
3. 结论
本文以水溶性的偶氮水杨醛吖嗪为比色传感器,在纯水溶液中实现了CN-的高选择性比色检测,最低检测限为0.16μmol/L。UV-Vis光谱实验、1H NMR滴定以及DFT计算结果表明,S对CN-的比色检测机制为偶氮酚羟基可逆的质子转移。S对CN-可逆的比色检测可通过检测试纸得以确证。重要的是,S可用于实际水样中CN-的检测,检出限(0.63μmol/L)低于我国生活饮用水卫生标准规定的CN-限值,因而具有潜在的实际应用价值。
‡共同第一作者
-
-
[1]
F.P. Guengerich, W.W. Johnson, T. Shimada, et al., Mutat Res. 402 (1998) 121-128. doi: 10.1016/S0027-5107(97)00289-3
-
[2]
Q. Zhou, D. Tang, Trends Anal. Chem. 124 (2020) 115814. doi: 10.1016/j.trac.2020.115814
-
[3]
Y. Lin, Q. Zhou, D. Tang, et al., Anal. Chem. 88 (2016) 7858-7866. doi: 10.1021/acs.analchem.6b02124
-
[4]
N.M. Danesh, H.B. Bostan, K. Abnous, et al., Trends Anal. Chem. 99 (2018) 117-128. doi: 10.1016/j.trac.2017.12.009
-
[5]
Z. Yu, C. Qiu, L. Huang, Y. Gao, D. Tang, Anal. Chem. 95 (2023) 4212-4219. doi: 10.1021/acs.analchem.2c05617
-
[6]
Y. Lin, Q. Zhou, D. Tang, R. Niessner, D. Knopp, Anal. Chem. 89 (2017) 5637-5645. doi: 10.1021/acs.analchem.7b00942
-
[7]
S. He, Q. Huang, Y. Zhang, et al., Chin. Chem. Lett. 32 (2021) 1462-1465. doi: 10.1016/j.cclet.2020.09.047
-
[8]
Z. Wei, K. Luciano, X. Xia, ACS Nano 16 (2022) 21609-21617. doi: 10.1021/acsnano.2c10574
-
[9]
G. Xing, W. Zhang, N. Li, Q. Pu, J.M. Lin, Chin. Chem. Lett. 33 (2022) 1743-1751. doi: 10.1016/j.cclet.2021.08.073
-
[10]
X. Tang, Q. Zhang, Z. Zhang, et al., Anal. Chim. Acta. 1078 (2019) 142-150. doi: 10.1016/j.aca.2019.06.015
-
[11]
G. Chen, X. Chen, G. Xu, et al., Food Chem. 412 (2023) 135580. doi: 10.1016/j.foodchem.2023.135580
-
[12]
S. Ren, Q. Li, J. Wang, et al., J. Hazard. Mater. 402 (2021) 123781. doi: 10.1016/j.jhazmat.2020.123781
-
[13]
Z. Li, W. Zhang, Q. Zhang, P. Li, X. Tang, ACS Nano 17 (2023) 19359-19371. doi: 10.1021/acsnano.3c06930
-
[14]
L. Yin, T. You, H.R. El-Seedi, et al., Food Chem. 396 (2022) 133707. doi: 10.1016/j.foodchem.2022.133707
-
[15]
L. Wang, X. Wang, L. Cheng, et al., Biosens. Bioelectron. 189 (2021) 113360. doi: 10.1016/j.bios.2021.113360
-
[16]
D. Hong, E.J. Jo, K. Kim, M.B. Song, M.G. Kim, Small 16 (2020) 2004535. doi: 10.1002/smll.202004535
-
[17]
D. Hong, K. Kim, E.J. Jo, M.G. Kim, Anal. Chem. 93 (2021) 7925-7932. doi: 10.1021/acs.analchem.1c00623
-
[18]
P. Nandhakumar, C. Muñoz San Martín, B. Arévalo, et al., ACS Sens. 8 (2023) 3892-3901.
-
[19]
K. Kunpatee, K. Khantasup, K. Komolpis, et al., Biosens. Bioelectron. 242 (2023) 115742. doi: 10.1016/j.bios.2023.115742
-
[20]
J.A. Bard, Electrogenerated Chemiluminescence, Marcel Dekker, New York, 2004.
-
[21]
S. Li, Y. Liu, Q. Ma, Trends Anal. Chem. 110 (2019) 277-292. doi: 10.1016/j.trac.2018.11.019
-
[22]
H. Xu, X. Zhu, J. Wang, Z. Lin, G. Chen, Luminescence 34 (2019) 308-315. doi: 10.1002/bio.3596
-
[23]
Y. Hou, Y. Fang, Z. Zhou, et al., Adv. Opt. Mater. 11 (2023) 2202737. doi: 10.1002/adom.202202737
-
[24]
J. Shu, Z. Qiu, D. Tang, Anal. Chem. 90 (2018) 9691-9694. doi: 10.1021/acs.analchem.8b03011
-
[25]
Z. Yu, H. Gong, M. Li, D. Tang, Biosens. Bioelectron. 218 (2022) 114751. doi: 10.1016/j.bios.2022.114751
-
[26]
X. Zhang, J. Zhang, X. He, et al., Front. Plant Sci. 8 (2017) 1611. doi: 10.3389/fpls.2017.01611
-
[1]
-
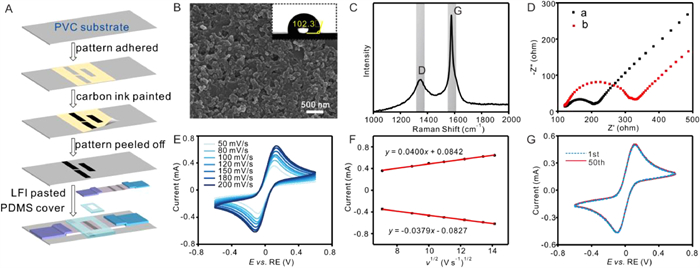
Figure 2 (A) The construction progress of ECL test strips. (B) Scanning electron microscope (SEM) image and water contact angle (inset) of the surface of carbon ink-modified PVC. (C) Raman spectrum of carbon ink electrode surface. (D) Electrochemical impedance spectroscopy (EIS) profiles of (a) the carbon ink modified PVC three-electrode system and (b) all-in-one ECL test strip. (E) Cyclic voltammograms of all-in-one ECL test strips under different scan rates. (F) Plots of anodic and cathodic peak currents vs. the square root of the scan rate (v1/2). (G) CV current signals of all-in-one ECL test strip scanned for continues 50 cycles (scan rate of 100 mV/s). All the EIS and CV measurements were executed in 0.1 mol/L KCl containing 50 mmol/L [Fe(CN)6]3−/4− solution.
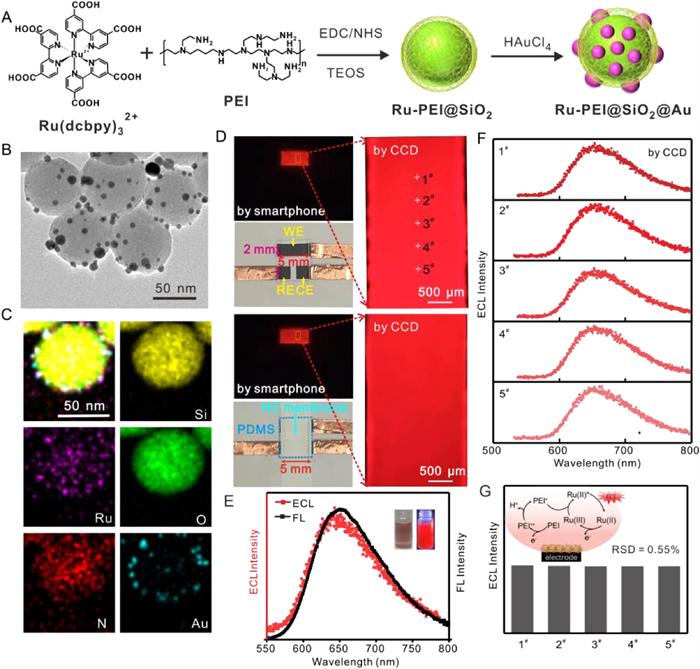
Figure 3 (A) Diagram of synthesis process, (B) transmission electron microscopy (TEM) image and (C) energy dispersive X-ray spectroscopy (EDX) mapping images of Ru-PEI@SiO2@Au. (D) ECL images recorded by smartphone or CCD camera before (top) and after (down) covering the three-electrode PVC substrate with a strip tested in 50 µL 0.1 mol/L PBS (pH 7.5) solution containing Ru-PEI@SiO2@Au. (E) ECL-wavelength spectrum and FL spectrum of Ru-PEI@SiO2@Au dispersions. Insert showed the photographs of Ru-PEI@SiO2@Au dispersions under visible (left) and UV-light (λ = 365 nm, right). (F) ECL-wavelength spectra and (G) the corresponding ECL intensities of different five points on the ECL test strips.
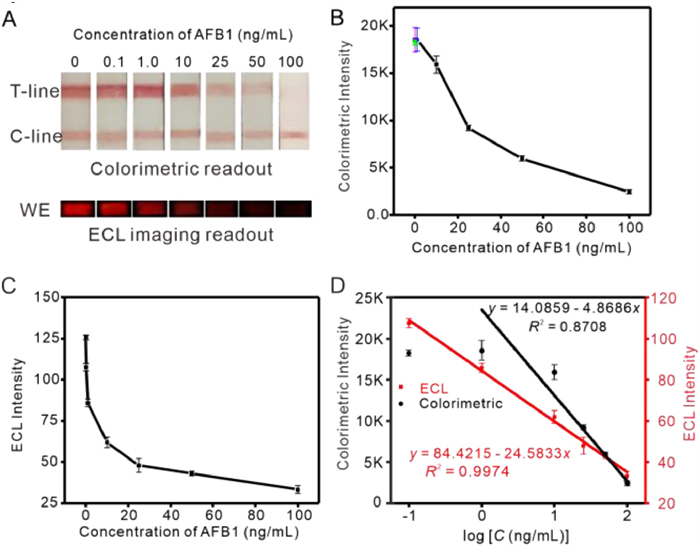
Figure 4 (A) Colorimetric and ECL imaging photographs of test strips for detection a series concentration of AFB1 standards. The corresponding (B) colorimetric and (C) ECL intensities analyzed by ImageJ. (D) Linear relationships of colorimetric or ECL imaging intensities on the logarithm of the AFB1 concentrations.
-
计量
- PDF下载量: 2
- 文章访问数: 729
- HTML全文浏览量: 19

 下载:
下载:

 下载:
下载:
 下载:
下载:

